La chiave della salute è nell’intestino: il microbioma
Oggi affronteremo insieme un argomento che interessa indistintamente bambini, adulti e anziani, parleremo del nostro intestino e dei batteri che ospita e che determinano il nostro stato di salute/malattia.
Fino a poco tempo fa, la microbiologia umana si basava sull’identificazione di microbi singoli, come batteri, funghi e virus, spesso isolati da pazienti con infezioni acute o croniche.
Grazie ad analisi biochimiche (genomica, trascrittomica, proteomica, metabolomica) sono stati individuati e classificati diversi microrganismi in un determinato ecosistema (microbiota), nel tratto gastrointestinale, sulla pelle, nelle vie respiratorie, nel tratto urogenitale e altri distretti, e di valutare tutti i genomi di questi ecosistemi (microbioma), con i relativi prodotti genetici.
Da queste analisi si è visto che ogni individuo ha il proprio e unico microbiota che svolge un ruolo nell’insorgenza delle malattie.
Queste nuove intuizioni si traducono, quindi, in diagnostica, terapeutica e misure preventive nel contesto della medicina personalizzata/di precisione.
La comunità microbica intestinale
La chiave della salute è nell’intestino: il microbioma.
La colonizzazione dei batteri nell’intestino umano inizia alla nascita con un rapida espansione della diversità batterica che si evolve e diventa relativamente stabile in età adulta.
La composizione della comunità microbica intestinale è influenzata da fattori endogeni ed esogeni.
Ad esempio, fattori esogeni che condizionano la popolazione microbica possono essere la dieta (integratori alimentari, allattamento al seno, latte artificiale), l’uso di xenobiotici, compresi antibiotici e altri farmaci.
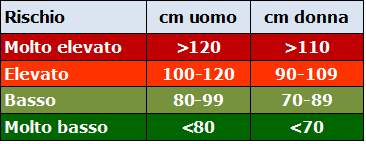
Studi suggeriscono che la caratterizzazione dettagliata della composizione, della funzione e della variazione del microbioma intestinale umano tra i diversi siti del corpo, possono nello sviluppo di malattia nell’uomo (Figura 1A e B).
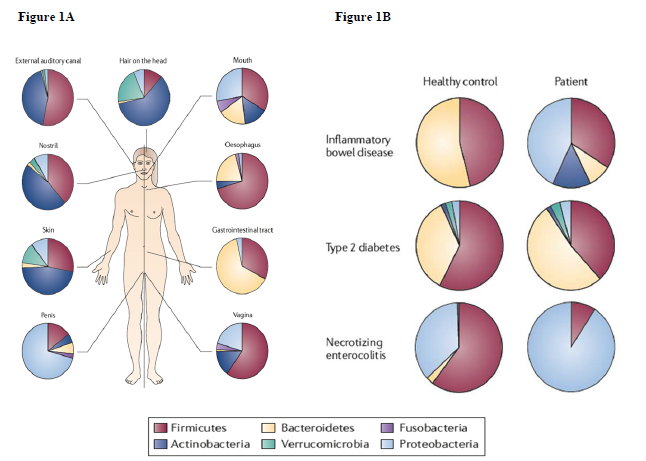 Fig. 1B
Fig. 1B
Figura 1: (A) Microbiomi diversi negli esseri umani; (B) Il microbioma intestinale in individui e pazienti sani
Tenuto conto delle numerose e diverse funzioni fisiologiche del microbiota intestinale nella salute umana (tabella 1), non è sorprendente che sia coinvolto anche in malattie gastrointestinali e non gastrointestinali, come l’obesità/sindrome metabolica e aterosclerosi/cardiovascolare, nonché neurologica, psichiatrica e neurodegenerativa malattie, rendendolo uno degli argomenti attuali più dinamici nella ricerca biomedica (tabella 2). Di seguito, alcuni esempi saranno discussi in modo più dettagliato.
| Fisiologia dell’ospite | Riferimenti |
| |
| Immunità adattativa | 20 |
| Autoimmunità | 21 |
| Immunità innata | 22 |
| Proliferazione cellulare | 23 |
| Densità ossea | 24 |
| Vascolarizzazione | 25 |
| Segnalazione neurologica | 26 |
| Biosintesi | |
| Neurotrasmettitori | |
| Ormoni steroidei | |
| Vitamine | |
| Metabolismo | |
| Componenti dietetici | |
| Sali biliari | |
| Droghe | |
| Xenobiotici | |
Tabella 1: Funzioni della comunità microbica intestinale nella salute umana (esempi).
| Allergie / Protezione dalle allergie |
| Aterosclerosi / trombosi / malattie cardiovascolari |
| Cancro |
| Diabete mellito |
| Malattie infiammatorie immuno-mediate |
| Malattie infiammatorie intestinali |
| Sclerosi multipla |
| Artrite reumatoide |
| Psoriasi |
| Kwashiorkor |
| Malattie del fegato |
| Sindrome metabolica / obesità |
| Malattie neurodegenerative, psichiatriche e neurodegenerative |
| Autismo |
| Depressione |
| Morbo di Alzheimer, morbo di Parkinson |
| Xenobiotici |
Tabella 2: Associazioni di malattie con la comunità microbica intestinale (esempi)
La chiave della salute è nell’intestino: il microbioma
Malattie infiammatorie intestinali
Le malattie infiammatorie intestinali (IBD) negli esseri umani includono colite ulcerosa (UC) e malattia di Crohn (CD), caratterizzate da un’infiammazione dello strato mucoso del colon nell’UC e dal coinvolgimento transmurale gastrointestinale, compresi i siti extraintestinali in CD.
Sebbene la patogenesi dell’IBD non sia pienamente compresa, è chiaro che la sua patologia dipenda anche dalla comunità microbica intestinale.
Inoltre, sono state individuate specifiche alterazioni del microbiota intestinale nelle IBD che possono fungere da biomarcatori per la predisposizione, attività/gravità e reattività alla terapia.
I tre componenti – ambiente, genetica dell’ospite e comunità microbica – interagiscono per mantenere l’omeostasi l’intestino.
L’interruzione della stabilità di questa interazione può essere un innesco per lo sviluppo della malattia. Due recenti pubblicazioni aprono nuovi scenari sulla patogenesi dell’IBD attraverso il cambiamento della composizione microbica intestinale.
Obesità
Negli ultimi anni si sta assistendo ad un incremento di studi e pubblicazioni in merito al ruolo del microbiota intestinale nella patogenesi dell’obesità.
L’obesità è una patologia cronica, multifattoriale, correlata a diverse patologie, cardiovascolari, metaboliche, respiratorie, osteoarticolari. Nella patogenesi dell’obesità interagiscono in maniera molto articolata e complessa diversi fattori: comportamentali, psicologici, ambientali, metabolici, neuro-immuno-endocrini.
E’ stato osservato che i microrganismi che colonizzano il tratto gastroenterico non sono solo ospiti quasi inerti ma sono attivi protagonisti di vivaci interazioni tra il tratto gastroenterico e il sistema neuro-immuno-endocrino.
Nell’individuo normopeso si riconoscono tre tipi (phyla) batterici principali: Firmicutes, Actinobacteria e Bacteroidetes.
Studi effettuati sia nel topo che nell’uomo hanno evidenziato una variazione nella composizione del microbiota intestinale nei soggetti obesi con un incremento dei Firmicutes e una riduzione dei Bacteroidetes.
Il microbiota può incidere sull’equilibrio nutrizionale e metabolico dell’organismo modulando la capacità di estrarre energia dagli alimenti della dieta e interagendo con il metabolismo glico-lipidico.
I metaboliti rilasciati dalla fermentazione di polisaccaridi complessi della dieta possono aumentare l’assorbimento di glucosio, stimolare la lipogenesi, modificare la composizione in acidi grassi del tessuto adiposo e del fegato, alterare la permeabilità della barriera mucosa intestinale, alterare la risposta immunitaria, contribuire ad uno stato di infiammazione cronica sistemica e allo stato di insulinoresistenza correlato all’obesità.
Obesità, insulino-resistenza e biafra (malnutrizione a carenza proteica) sono esempi per i quali è stata dimostrata una correlazione tra disbiosi e lo stato clinico del paziente. Inoltre, il trapianto di microbiota fecale da donatori sani a pazienti ha portato a un miglioramento clinico.
Rischio di aterosclerosi e trombosi
Recenti studi suggeriscono che i microbi intestinali sono coinvolti nell’aterosclerosi. In questo contesto, gli alimenti ricchi di colina, fosfatidicicolina e carnitina come carne, tuorlo d’uovo e latticini ad alto contenuto di grassi, vengono processati dai microbi intestinali dopo ingestione alimentare in trimetilamina (TMA) e nel fegato poi ossidati in N-ossido TMA (TMAO), metabolita che accelera l’aterosclerosi. Livelli ematici elevati di TMAO sono associati ad un aumento del rischio di malattie cardiache aterosclerotiche.
Inoltre, Il TMAO aumenta l’attività delle piastrine e gli eventi trombotici in modelli animali privi di germi, confermando il ruolo chiave del microbiota.
Questi risultati rivelano un legame precedentemente sconosciuto tra specifici nutrienti alimentari, microbi intestinali e rischio di trombosi (Figura 2).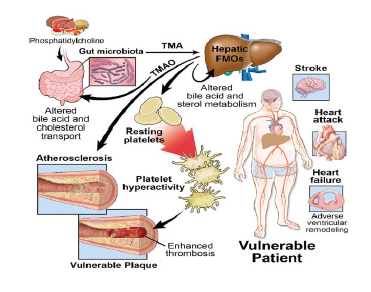
Figura 2: La trimetilamina microbica intestinale (TMA) e il rischio di aterosclerosi/trombosi
In un recente studio, Wang ha dimostrato che 3,3-dimetilo-1-butanolo (DMB), un analogo strutturale di colina, blocca la formazione del TMA intestinale attraverso l’inibizione della TMA-liasi (enzima necessario alla produzione), che si traduce in livelli di TMAO ridotti. Sembra chiaro come il DMB possa ritenersi un nuovo approccio per la prevenzione e/o trattamento dell’aterosclerosi (Figura 3).
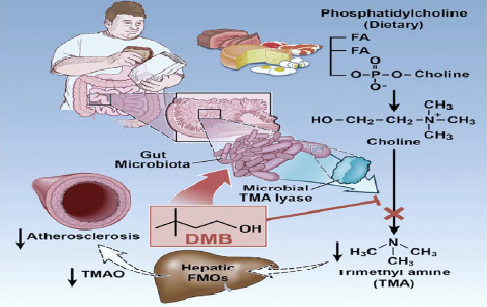
Figura 3: Inibizione della sintesi di trimetilamina microbica intestinale (TMA) di 3,3-dimetil-1-butanolo (DMB) e attenuazione dell’aterosclerosi.
Malattie neurosviluppo, psichiatriche e neurodegenerative
Gli studi sulla comunicazione intestino-cervello dimostrano il ruolo della comunità microbica intestinale nella modulazione, nella maturazione e nella funzione delle cellule del sistema nervoso centrale (SNC) nonché nell’attivazione di cellule immunitarie periferiche coinvolte nella neuroinfiammazione, nelle lesioni cerebrali, autoimmunità e neurogenesi.
Topi privi di germi, allevati in condizioni sterili, o topi impoveriti di del loro microbiota intestinale, mediante antibiotici, mostra importanti alterazioni nei comportamenti o neuropatologie che caratterizzano disturbi neurosviluppo, psichiatrico e neurodegenerativo.
Questi includono, tra gli altri, lo spettro autistico, la depressione, il morbo di Alzheimer, il Parkinson (tabella 2).
Un esempio impressionante del un ruolo patogeno della comunità microbica intestinale è nel morbo di Parkinson (PD). Nei pazienti con PD, si formano aggregati di una proteina, alfa-sinucleina (AS), sia nelle cellule cerebrali che nell’intestino, segno distintivo della malattia. In pazienti affetti da PD la motilità gastrica è spesso compromessa e il livello di AS intestinale è elevato.
In modelli animali, topi che sovraesprimono AS, infatti, sviluppano deficit neurologici simili a quelli dei pazienti con PD.
Recentemente, tre test hanno dimostrato un ruolo centrale della comunità microbica intestinale nella patogenesi del PD
(Figura 4):
(1) topi privi di germi sviluppato meno placche e quasi nessun sintomo neurologico rispetto ai controlli colonizzati convenzionalmente,
(2) il trattamento (2) dei topi con PD con antibiotici ha evidenziato un miglioramento dei deficit neurologici e
(3) i trapianti fecali da pazienti con PD a topi privi di germi ha portato a deficit neurologici simili a PD
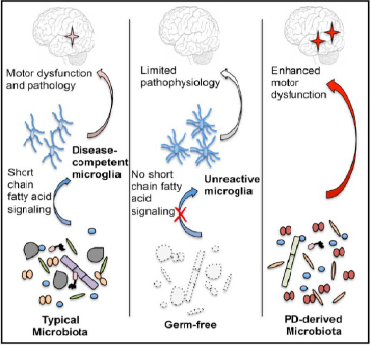
Figura 4: Contributo degli acidi grassi a catena corta (SCFA) e del trapianto fecale da parte di pazienti affetti da Parkinson (PD) alla patogenesi della PD e la sua prevenzione mediante l’eliminazione del microbiota intestinale.
Da ricerche precedenti si sapeva che gli acidi grassi a catena corta (molecole prodotte dalla digestione di fibre nell’intestino da parte dei batteri) sono in grado di attivare risposte immunitarie nel cervello. Il ruolo delle cellule della microglia – cellule che si trovano nel cervello con funzioni di difesa immunitaria – è considerato infatti sempre più importante nelle malattie neurodegenerative come il Parkinson e l’Alzheimer.
I ricercatori in questo nuovo studio hanno osservato che, nei topi privi di batteri intestinali, la somministrazione di acidi grassi a catena corta è in grado di stimolare l’attivazione delle cellule della microglia e migliorano la fisiopatologia della PD.
L’identificazione dei batteri che concorrono nella patogenesi del PD e il meccanismo che porta alla deposizione delle placche AS neurotossiche attendono ulteriori chiarimenti.
Conclusioni e prospettive
La ricerca biomedica ha compiuto importanti progressi negli ultimi anni e mantiene la promessa di fornire nuove opzioni diagnostiche, preventive e terapeutiche per i pazienti con patologie ereditarie o acquisite, maligne o non.
La popolazione intestinale è coinvolta in un gran numero di funzioni biologiche e in (tabella 1) e nella genesi di numerose malattie, gastrointestinali e non, come l’obesità, la sindrome metabolica, la trombosi, malattie psichiatriche e neurodegenerative (tabella 2).
E’ evidente l’importanza che può assumere un intervento dietetico mirato sul benessere del microbiota intestinale e, di conseguenza, sulla salute dell’uomo. E’ importante un regime alimentare ricco di fibre e verdure e dal regime calorico contenuto.
Fonte: The Human Microbiome: An Emerging Key Player in Health and Disease
C. Author: Hubert E. Blum – Department of Medicine II, University Hospital Freiburg, Freiburg, Germany
Se questo articolo ti è piaciuto, condividilo pure con i tuoi amici e buona lettura.
0 Likes2,436 Views


 Fig. 1B
Fig. 1B